FLIPR和电压敏感探针
简介
FLIPRTETRA和电压敏感探针:比率检测氯化钡诱导的大鼠嗜碱性白血病细胞上内向整流钾通道(Kir)的变化
离子通道和转运体是位于细胞膜上调控离子穿过生物膜的蛋白质。对这些蛋白质的研究已经引起了心律失常、高血压和神经紊乱等疾病的药物治疗开发。同时,这些蛋白质也是药物不良反应潜在的作用位点。高通量筛选方法在使用最小量化合物产生有用数据方面具有高效率和成本效益好等特点。FLIPRTETRA® 系统配置了390–420nm波长激发光LED以及440–480nm和565–625nm波长的滤光片,使用电压敏感探针(Voltage Sensor Probe, VSP)染料用于基于FRET原理的高通量筛选(HTS)实验,提供了一种新型的细胞基础的膜电位变化检测方法。在本实验中,包含了一种内向整流钾通道(Kir)的大鼠嗜碱性白血病细胞——RBL-2H3被诱导引起了细胞膜电位变化。氯化钾被用来引起细胞膜去极化,而氯化钡被用于阻断这个去极化反应。比率化分析对FRET数据进行了背景校正和直接对比。本篇应用文章展示了FLIPRTETRA系统结合VSP染料所带来的灵敏和高效的离子通道与转运体引起的细胞膜电位变化的检测实验。
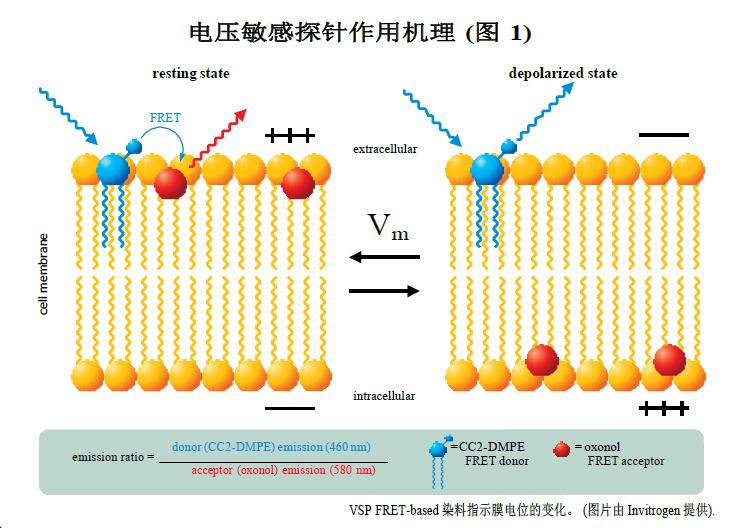
基于FRET的电压敏感探针作用机理
电压敏感探针是一种基于荧光共振能量转移(Fluorescence Resonance Energy Transfer ,FRET)原理的用于高通量离子通道药物研发的实验技术。FRET供体--香豆素-磷脂(coumarin-phospholipid,CC2-DMPE)只结合在细胞膜外侧。FRET受体是可移动的、带负电荷的疏水性类菁染料化合物染料(oxonol)[DiSBAC2(3)或DiSBAC4(3)],根据膜电位变化结合在细胞膜的一侧。静息细胞膜电位是负的。因而,两个探针都结合在细胞膜的外侧,实现有效的FRET效应。390–420nm波长LED 激发CC2-DMPE供体探针,从oxonol受体探针处产生580nm波长强的红色荧光信号。当细胞膜电位变正后,例如KCl引起的细胞去极化,oxonol受体探针快速的改变位置至膜的另一侧。因此,每个oxonol受体探针对细胞电位变化“感受“并反应。这种转移位置打破了FRET效应,CC2-DMPE供体探针激发后在460nm波长产生了强的蓝色荧光信号。
材料
RBL-2H3:含有内向整流钾通道(Kir)的大鼠嗜碱性白血病细胞 (ATCC Cat. #CRL-2256)
培养基:Eagle’s Minimum Essential Media (ATCC Cat. #30-2003), 10% FBS (Hyclone Catalog Cat. #SH-30071)
不含钙、镁的PBS (Invitrogen Cat. #14190-144) Trypsin/EDTA (0.05% Trypsin/1mM EDTA) (Invitrogen Cat. #25300-054)
VSP溶液-1:160 mM NaCl (Sigma Cat. #S-5886), 4.5 mM KCl, (Sigma Cat. #P5405), 2 mM CaCl2 (Sigma Cat. #C-7902), 1 mM MgCl2 (Sigma Cat. #M-4880), 10 mM glucose (Sigma Cat. #G-7021), 10 mM HEPES (Invitrogen Cat. #15630-080), pH 7.4
高钾溶液:164 mM KCl, 2 mM CaCl2, 1 mM MgCl2, 10 mM glucose, 10 mM HEPES, pH 7.4
无菌水 (Irvine Scientific Cat. #9309)
DMSO (Dimethyl Sulfoxide, Aldrich Cat. #47,230-1)
氯化钡 (Sigma Cat. #B-0750)
Pluronic F127 (Invitrogen Cat. #P3000)
电压敏感探针试剂盒:DisBac2(3)和CC2-DMPE (Invitrogen Cat. #K1016), VABSC-1 背景抑制染料 (Invitrogen Cat. #K1019)
FLIPRTETRA 高通量荧光检测分析系统(Molecular Devices)
方法
细胞准备
用胰酶消化预先培养的RBL-2H3细胞,实验前18-24小时清洗并种植在BD BioCoat™多聚赖氨酸包被的384孔板 (Cat. #356663, BD Biosciences)中,每孔12,500个细胞。细胞在37°C和5% CO2条件下过夜培养。实验开始当天母液、染料和缓冲液可室温放置。VSP加载缓冲液和氯化钡浓度梯度化合物在VSP-1缓冲液中配制。
准备VSP加载缓冲液
CC2-DMPE缓冲液:
Step 1 准备5mM DMSO母液并分装保存至-20°C。
Step 2 实验开始当天,准备一份工作溶液。CC2-DMPE母液和同体积的10% Pluronic Acid混合并随后用VSP-1溶液稀释至5μM。
Step 3 缓冲液在使用前充分混合并避光。
DiSBAC2(3)缓冲液:
Step 1 准备12mM DiSBAC2(3)的DMSO母液并保存至 -20°C.
Step 2 准备200mM VABSC-1的水质母液并在室温下避光保存。更多说明参考Invitrogen VSP 产品手册
Step 3 实验开始当天,用VSP-1溶液准备4μM DiSBAC2(3)的工作溶液,其中含有0.2μM VABSC-1 淬灭剂。在FLIPRTETRA系统中进行VSP染料实验除安装相应的LED和滤光片之外没有其它特别要求。
细胞中加载染料
Step 1 去除384孔板中所有孔的培养基,并加入50μL VSP-1溶液代替。
Step 2 立即去除VSP-1溶液并加入25μL的CC2-DMPE加载缓冲液。
Step 3 室温下细胞板覆盖避光孵育30分钟。
Step 4 30分钟后去除CC2-DMPE加载缓冲液并加入50μL的VSP-1溶液。
Step 5 立即去除VSP-1并加入25μL的4μM DiSBAC2(3)和0.21 μM VABSC-1加载缓冲液。
Step 6 加入10X 浓度的BaCl2 化合物(离子通道抑制剂)至相应的孔中
Step 7 室温下细胞板避光孵育30分钟。更多详细信息参考Invitrogen VSP使用指南。
FLIPRTETRA 系统配置和校正
FLIPRTETRA 系统的操作软件ScreenWorks.具有非常友好的用户界面,便于进行实验方案的编辑和参数设置。更多信息可参考FLIPRTETRA 用户指南。系统自带一个黄色检测板可用于校正390–420nm激发光源LED和565–625nm发射光滤片。 含有7-二乙胺香豆素-3-羧酸的检测板被用于校正390–420nm激发光源LED和440–480nm发射光滤片,具体步骤见下。
390–420 nm激发光源LED和440–480 nm 滤光片 校正板制备
Step 1 配制0.02M的7-二乙胺香豆素-3-羧酸DMSO母液(Molecular Probes Cat. #D-1421)。
置于离心管中涡旋混合。
Step 2 分装成小份并保存于-20°C。
Step 3 在校正的1小时内,溶解一份第二步母液并在同样的用于染料加载的缓冲液中稀释成20–30 mL 10-5 M溶液。调节pH值至7.4,涡旋混合。
Step 4 每孔加入分装的香豆素溶液25μL(384孔板)或100μL(96孔板)。
在FLIPRTETRA系统中运行VSP实验
实验溶液体积、加样高度和速度等参数取决具体具体实验和细胞类型的要求来进行优化,以避免吹动孔底的细胞。
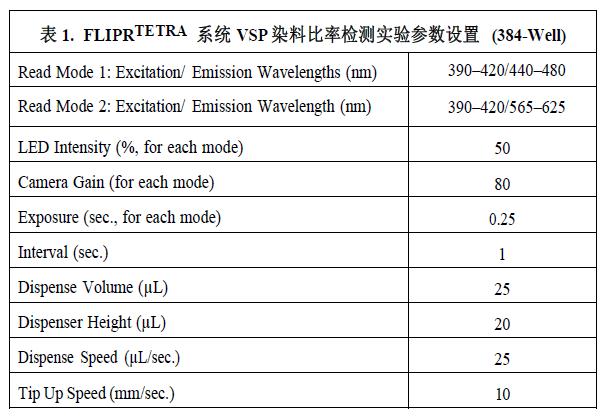
表1是推荐的RBL-2H3细胞实验机器参数设置,以供参考。
在FLIPRTETRA系统中,加入25μL高K+去极化溶液前440–480nm和565–625nm的信号依次被记录10秒并在加样后40秒再次被记录10秒。实验中这两个时间点平均的信号记录构成了比率分析的基础。
比率数据计算
比率数据分析提供了背景校正和FRET的440–480nm和565–625nm数据的直接对比。同一细胞的数据结果可以在极化和非极化状态下进行对比。图2所示是来自FLIPRTETRA系统的一组数据示例。
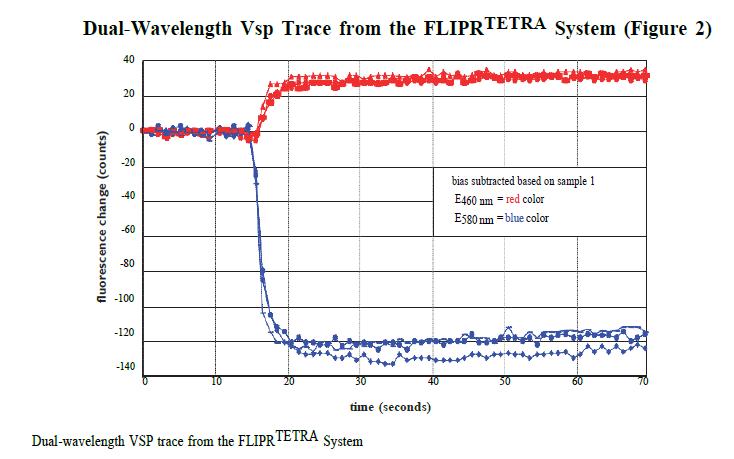
在相同的数据窗口中,检测了加样前和加样后40-60
地 址: 上海市长宁区福泉北路518号1座501室 联系人: 市场部 电 话: 4008203586 传 真: 021-33721066 Email:info.china@moldev.com
美谷分子仪器(上海)有限公司
商家主页
