编者按:
当听觉神经系统中对声音传导、感知或者综合分析的各级神经元件发生器质性或者功能性障碍时,就会导致不同程度的听力减退。耳蜗是听觉传导系统的组成部分,将传入内耳的机械性振动信号转化成生物电信号。位于耳蜗基底膜上的柯蒂氏器靠近耳蜗中心的一排称为内毛细胞(IHCs),远离中心的三排称为外毛细胞(OHCs)。毛细胞是听觉系统的感觉受体。自然衰老、药物治疗或者某些特定疾病会造成毛细胞的死亡,进而导致不可逆的听力损伤。若能使用细胞重编程技术,定向分化为不同功能的IHCs或者OHCs,将能完全逆转听力障碍。但目前仍不清楚耳蜗毛细胞编程为IHCs或者OHCs的分子机制。
耳蜗使用两种类型的机械感觉细胞来检测声音。一排内毛细胞(IHCs)与神经元形成突触,将感觉信息传递给大脑,三排外毛细胞(OHCs)选择性地放大听觉输入。到目前为止,已知有两种转录因子参与了OHCs的特异性分化,但还没鉴定出在IHCs分化中发挥作用的转录因子。
小编在这里给大家推荐我司客户美国西北大学范伯格医学院麻醉科García-Añoveros J教授和Anne Duggan教授团队于2022年5月4日在线发表于《Nature》的研究论文。OHCs的一种转录因子INSM1在关键的胚胎期起巩固OHCs命运的作用,可防止OHCs转分化为IHCs。在没有INSM1的情况下,胚胎OHCs错误表达一组核心IHCs特异性基因,而这些基因经作者预测与IHCs分化有关。作者还发现其中一个基因Tbx2是小鼠IHCs与OHCs分化的主要调节因子。敲除胚胎IHCs中的Tbx2导致其发育为OHCs,表达早期OHCs标记物,如Insm1,在IHCs的位置上最终成为完全成熟的OHCs。此外,Tbx2对Insm1具有上位性:在两个基因都缺失的情况下,耳蜗只产生OHCs,这表明TBX2对于INSM1缺陷OHCs向IHCs的异常转分化以及正常IHCs分化是必要的。在出生后分化程度较大的IHCs中敲除Tbx2,使其直接转分化为OHCs,用成熟和非胚胎OHCs的特征取代IHCs特征。最后,Tbx2在OHCs中的异位表达导致其转分化为IHCs。因此,Tbx2对于使IHCs区别于OHCs来说既是必要的,也是充分的,并在整个发育过程中保持这种差异。
一、胚胎期敲除Tbx2导致在IHCs位置产生OHCs
首先作者推测驱动毛细胞转变为IHCs的特异性分化,应该有三个条件:第一该基因类似于转录因子能调控多个基因的表达;第二该基因特异性表达在IHCs,而在OHCs不表达;第三在OHCs向IHCs转变的过程中该基因由沉默状态变成活跃状态。按照这三个条件去筛选,研究人员找到了T-box转录因子家族成员-Tbx2。
通过原位杂交实验,研究人员发现胚胎期Tbx2表达在小鼠耳蜗骨中膜上皮细胞和柯蒂氏器内隔室细胞(包括IHCs)。但是在柯蒂氏器外隔室细胞(包括OHCs)中几乎检测不到Tbx2的表达。因此,进一步研究人员关注Tbx2在IHCs中的功能。
INSM1是OHCs特异性分化的转录因子,当胚胎期INSM1功能不足的情况下,导致毛细胞容易转化为IHCs。而Tbx2只在INSM1功能不足的导致转分化的OHCs中表达,而在没发生转分化的OHCs中不表达。并且正常发育状态下,没有毛细胞能同时表达INSM1和Tbx2两种分子,因此可以推测Tbx2可能是分化为IHCs的关键转录因子。
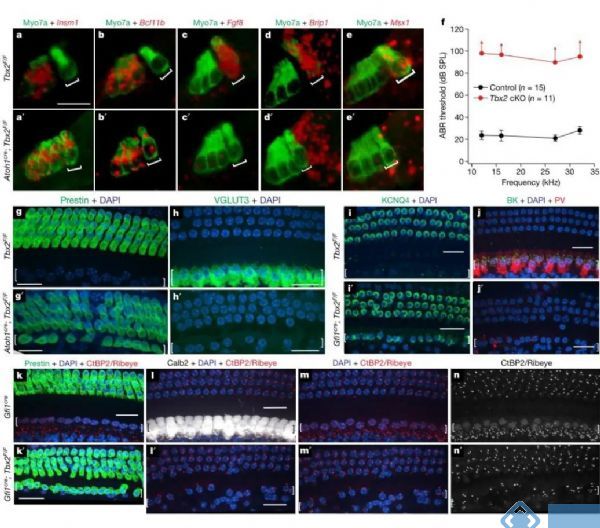
进一步,使用Atoh1-cre在胚胎期新生毛细胞中条件性敲除Tbx2,发现IHCs位置的毛细胞都表达出OHCs的标记物Insm1和Bcl11b,并降低IHCs的标记物Fgf8、Brip1和Msx1表达。听性脑干反应(ABRs)检测也发现IHCs的功能明显降低。这些IHCs位置的毛细胞,在分子、解剖学和生理学上都没有IHCs的特征,缺少VGLUT3、CALB2、BK和CtBP2等IHCs的生物标记,而具有Prestin、KCNQ4和PMCA2等OHCs的生物标记。研究人员把这些在IHCs位置上的OHCs称为ic-OHCs,并确定ic-OHCs展现出OHCs生理学特性,具备完整的OHCs功能。
图1. 胚胎期条件敲除Tbx2导致IHCs位置上产生OHCs
二、TBX2的调控等级高于INSM1
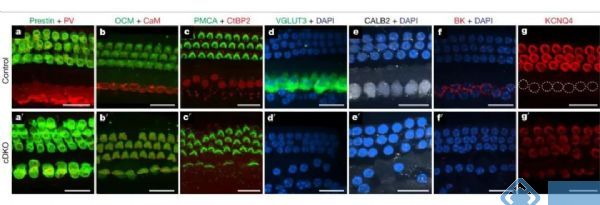
上述实验证明,在胚胎期TBX2功能不足的情况下,IHCs表达INSM1并分化为OHCs,而在INSM1功能不足的情况下,OHCs表达TBX2并转分化为IHCs。但是对于IHCs转分化为OHCs是否需要TBX2的参与,OHCs转分化为IHCs是否需要INSM1的参与这些问题仍不清楚。研究人员构建了INSM1和TBX2的毛细胞双敲除小鼠,发现在胚胎期敲除这两个基因之后,所有的毛细胞都分化成OHCs,并且所有的IHCs也转分化成了OHCs。尽管INSM1功能不足使OHCs容易分化为IHCs,但仍有一半的细胞分化为成熟的OHCs,因此INSM1对于OHCs的分化并不是必不可少的。但是从OHCs转分化为IHCs的过程中,Tbx2对于IHCs的形成却是不可或缺的,Tbx2功能不足的OHCs将无法转分成成为IHCs。基于以上结果可以得出初步结论:在调控作用上Tbx2的等级高于INSM1。
图2. TBX2的调控等级高于INSM1
三、胚胎晚期或者出生后敲除Tbx2导致IHCs向OHCs转分化
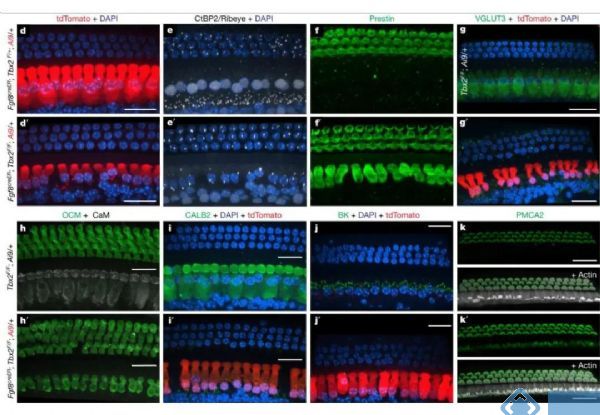
进一步研究发现,Tbx2不仅在IHCs开始分化时是必不可少的,在随后的分化过程和IHCs细胞状态的维持也是必需的。在胚胎晚期部分分化的IHCs中条件性敲除Tbx2,将导致敲除Tbx2的IHCs转分化成为OHCs。类似的,在出生后敲除Tbx2也会导致IHCs转分化为OHCs。
免疫组织化学的结果显示,在出生后敲除Tbx2的最初几天中,毛细胞分化成的IHCs从出生后的第一天开始表达OHCs标记PMCA2,从第四天开始表达Prestin,而IHCs标记VGLUT3则在第八天表达消失。
由于胚胎期敲除Tbx2会造成IHCs中Tbx2表达永久性降低,不利于研究IHCs分化的晚期是否需要Tbx2的参与。因此研究人员采用他莫昔芬启动的Cre-loxp技术,转基因小鼠在P0、P3、P7和P9的时间点单次注射他莫昔芬后,在不同时间段敲除Tbx2均会导致IHCs向OHCs的转分化。随着时间的推移,IHCs标记分子VGLUT3、CALB2、BK和CtBP2的表达明显降低;而OHCs标记分子prestin、oncomodrin和PMCA2的表达明显增加。
因此,Tbx2不仅在胚胎发育过程中细胞特异性分化为IHCs所必须,也是在出生后IHCs的分化和维持所必须,即Tbx2的持续存在可维持IHCs的细胞分子状态并阻止OHCs相关分子特征的表达。
图3. 胚胎晚期或出生后Tbx2的敲除导致IHCs转分化为OHCs
四、在OHCs中表达Tbx2导致其转分化为IHCs
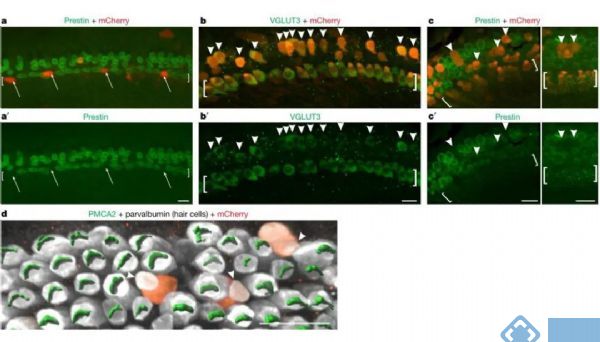
上述实验已经证实,在IHCs中敲除Tbx2会导致IHCs转分化成OHCs,而在INSM1敲除的OHCs中敲除Tbx2会阻止OHCs转分化形成IHCs。那么在OHCs中过表达Tbx2是否会介导OHCs转分化形成IHCs呢?带着这一问题,研究人员展开了以下实验。
构建AAV-TBX2-IRES-mCherry病毒(AAV载体为感染毛细胞的Anc80血清型),通过病毒感染在发育期的毛细胞中特异性表达Tbx2。研究首先在IHCs敲除Tbx2的细胞中部分恢复表达Tbx2,发现敲除Tbx2之后,IHCs转分化形成OHCs,但是在恢复Tbx2表达的IHCs无法转分化形成OHCs。随后将AAV病毒注射到耳蜗OHCs所在的位置上,发现AAV病毒表达的OHCs出现IHCs的分子标记物Vglut3,而OHCs自身的分子标记物Prestin和PMCA2表达显著减少,在OHCs中过表达Tbx2有利于OHCs转分化形成IHCs。因此,Tbx2是耳蜗毛细胞分化形成IHCs的充分且必要条件,Tbx2是决定毛细胞向IHCs或OHCs分化的主要调节因子。
图4. 在OHCs中表达Tbx2导致其转分化为IHCs
五、小结
综上所述,研究人员运用多种转基因小鼠,结合免疫荧光、电生理等研究手段,发现Tbx2是调节IHCs分化的命运决定因子。在Tbx2功能不足的情况下,IHCs不仅失去了其自身的分子标记物和功能特征,还会获得OHCs的分子标记物和功能特征。本文发现外毛细胞与内毛细胞转分化的分子机制,若能通过细胞重编程,定向恢复听力丧失中死亡的细胞,将为听力丧失患者的听力恢复带来新的希望。
本文利用AAV-Anc80构建了Tbx2过表达病毒载体靶向感染毛细胞,用于在发育中的耳蜗培养物中异位表达Tbx2。
本文使用产品
PT-2834 rAAV-CMV-Tbx2-IRES-mCherry-WPREs
相关产品
更多产品欢迎前来咨询!
扫码下载原文
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。