2022年5月20日,北京大学IDG麦戈文脑科学研究所、心理与认知科学学院、北大-清华生命科学联合中心王征课题组,在《eLife》在线发表题为“Mapping brain-wide excitatory projectome of primate prefrontal cortex at submicron resolution and comparison with diffusion tractography”的研究论文,报道了团队在猕猴大脑结合细胞类型特异的病毒标记方法和双光子成像技术成功构建了猕猴腹外侧前额叶(ventrolateral prefrontal cortex, vlPFC)的全脑兴奋性投射图谱,并与在11.7T超高场磁共振上获得的猕猴全脑神经纤维连接图谱进行比较,发现猕猴腹外侧前额叶与枕叶之间不存在直接的、单突触神经纤维连接通路。

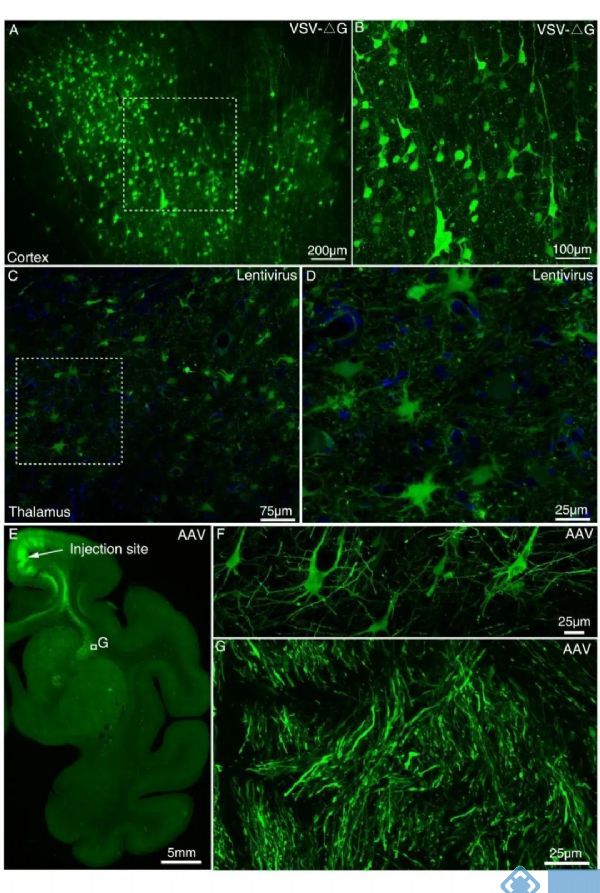
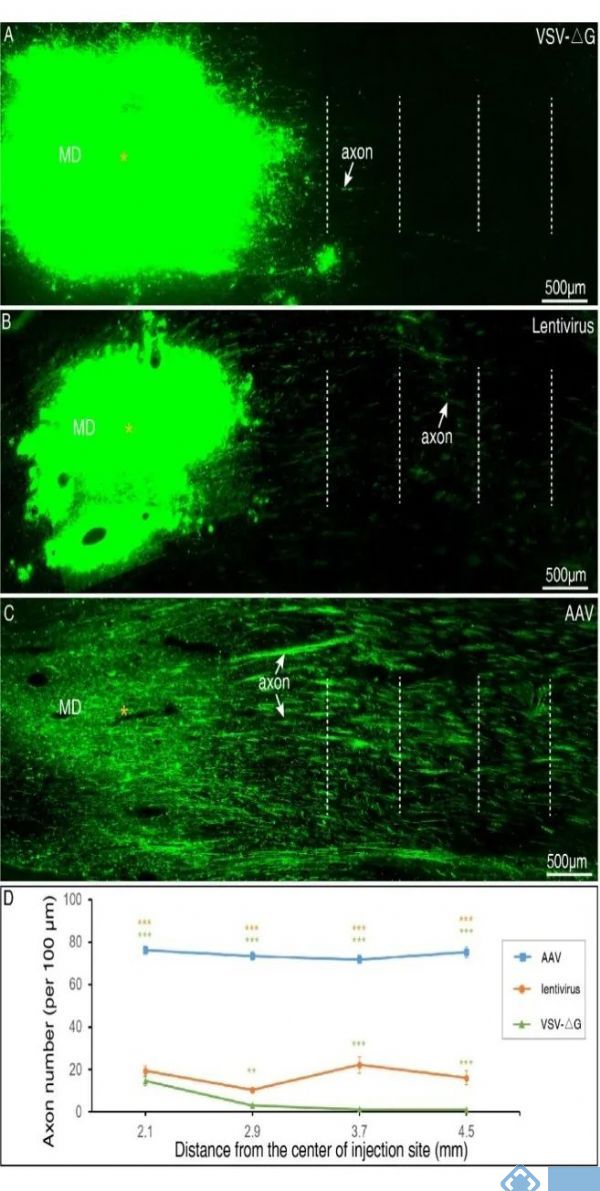
神经环路的结构解析是理解大脑高级功能的基础,可为脑疾病的诊断和治疗提供精确的标记和干预靶点,亦可为类脑智能技术提供创新架构和技术模拟的连接基础。介观层面重建模式动物大脑的神经环路已被科技创新2030—“脑科学与类脑研究”重大项目列为重要研究方向。介观水平的环路解析需要利用示踪剂标记神经元的结构,病毒载体类的示踪剂具有细胞类型特异性和更高的方向特异性。虽然已经有利用病毒载体研究猕猴大脑功能的报道,但是这些研究并没有提供轴突投射的路径信息,所以不同种类的病毒载体在猕猴大脑标记轴突的效率仍然需要系统地测试。自2015年起,王征课题组与中科院徐富强团队紧密合作,在猕猴大脑测试了多种在小鼠中应用比较成熟的病毒载体包括腺相关病毒(adeno-associated virus, AAV)、水泡性口炎病毒(vesicular stomatitis virus, VSV)和慢病毒(lentivirus)。结果发现这几种病毒都可以介导外源基因在猕猴大脑的表达,实现神经细胞胞体的标记(图1)。VSV-ΔG介导外源基因快速的表达,病毒表达5天便可以高亮地标记神经元胞体和近端凸起(图1A和B),但并不能观察到跨脑区的轴突投射,进一步延长表达时间(超过窗口期)导致被感染细胞的凋亡。慢病毒介导外源基因的表达持续且稳定,感染9个月后依然可以观察到被标记的神经细胞(图1C和D)。AAV标记轴突的效率相比于VSV-ΔG和慢病毒更高,比较适合在猕猴大脑上开展长程轴突标记(图2)。传统的组织切片光学成像往往伴随严重的组织形变,难以实现大范围的三维重建。近年来蓬勃发展的大尺度三维介观光学成像比如华中科技大学骆清铭和龚辉教授团队研创的MOST(显微光学切片断层成像系统)技术,都具有高通量自动化的特性,突破传统技术瓶颈,已经在啮齿类动物上完美实现了全脑介观成像。
图1.不同病毒载体在猕猴大脑的表达
图2.不同病毒载体在猕猴大脑标记轴突效果的对比
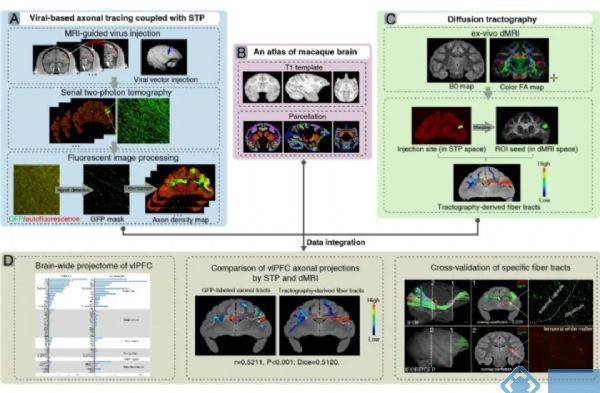
猕猴腹外侧前额叶脑区参与灵活决策、工作记忆等多种高级认知功能。王征实验室此前在转基因猕猴模型和临床患者上的研究成果揭示了腹外侧前额叶的异常与认知灵活性损伤密切相关(J Neurosci, 2020; Am J Psychiatry, 2021),并且发现腹外侧前额叶的结构与功能网络特征可用于指导改善临床病人抑郁、焦虑症状的治疗方案(J Neurol Neurosurg Psychiatry, 2021; Mol Psychiatry, 2022)。因此,深入完整地解析腹外侧前额叶的神经纤维连接图谱对全面解析其在脑认知和脑疾病中所扮演的角色至关重要。本研究在猕猴腹外侧前额叶注射携带兴奋性启动子CaMKIIα及融合报告基因Tau-GFP的腺相关病毒载体(AAV2/9)来选择性标记兴奋性轴突,采用连续光学成像构建了0.95×0.95×200μm空间分辨率的全脑神经纤维投射图谱(图3A),发现兴奋性轴突主要分布在前额叶内部不同区域,同时投射到颞叶、边缘系统、脑岛、顶叶和部分皮下核团。
扩散磁共振成像(diffusion MRI)主要利用水分子微观扩散的各向异性特征建模,以此推断神经纤维束的空间走向,重建全脑结构连接图谱(tractography),已广泛应用于动物和人体,是目前唯一的神经纤维活体示踪技术。但因其精确性和可靠性亟需验证,所重建的大脑神经连接图谱引发了诸多争议(Science, 2012),也限制了该技术在临床中的推广应用。王征课题组对11.7T超高场磁共振成像系统的软件序列和离体猴脑的成像方法进行优化后,可获得高达200×200×200μm的扩散磁共振影像数据,将其与病毒标记轴突荧光图像数据配准到标准猴脑空间(图3B,Cereb Cortex, 2021),以病毒标记注射的位点作为种子区域进行神经纤维追踪(图3C),随后在同一个空间比较两种不同模态、尺度的影像数据(图3D)。结果发现两种成像模态所得到的神经纤维投射具有较高的相关系数(皮尔逊相关系数为0.4624±0.0922;Dice相关系数为0.4312±0.0861),这为验证扩散磁共振成像技术提供了新的实验数据,同时也为桥接宏观与介观影像数据空间建立了可行的技术方法。
图3.构建猕猴腹外侧前额叶全脑介观与宏观连接图谱的主要流程
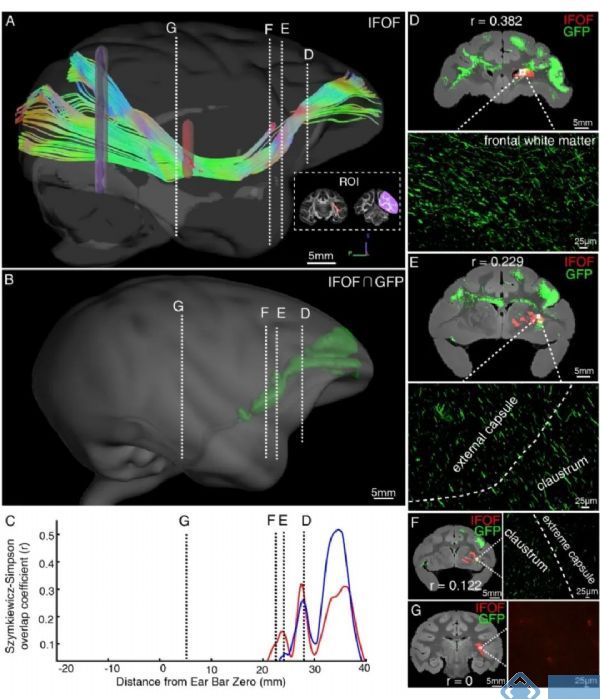
下额枕束(inferior fronto-occipital fasciculus, IFOF)是一条从额叶如腹外侧前额叶、眶额叶等区域出发,经外囊到达枕叶的神经纤维束。早在1909年哈佛大学医学院解剖学助理Curran解剖人脑白质纤维时就已发现(J Comp Neurol Psychology, 1909),但猕猴大脑的下额枕束是否存在始终没有定论。研究团队先利用扩散磁共振成像数据重建了下额枕束的投射路径,然后与病毒标记的荧光图像数据相比,发现腹外侧前额叶发出的兴奋性轴突只在前半脑与下额枕束存在较大的重合,随后大部终止于颞上回区域,但下额枕束则继续投射到枕叶部分(图4)。此结果揭示猕猴腹外侧前额叶与枕叶之间不存在直接的、单突触神经纤维连接,利用扩散磁共振成像技术观测到的下额枕束可能是一条间接、跨突触的神经通路,为解析领域内的重大争议问题提供了新的实验证据。此外,本研究也为开展猕猴介观神经连接图谱研究开辟了一条新路径。
图4.猕猴大脑下额枕束IFOF的比较:11.7T超高场磁共振成像与病毒示踪标记
中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)鄢明超博士和复旦大学类脑智能科学与技术研究院俞文文为该论文共同第一作者,王征研究员为唯一通讯作者。11.7T超高场磁共振影像数据在复旦大学张江国际脑影像中心完成采集,期间得到了王鹤青年研究员、张孝勇青年研究员的大力支持和帮助。本课题同时与浙江工业大学冯远静教授团队、中国科学院深圳先进技术研究院徐富强研究员紧密合作,得到了科技部科技创新2030-“脑科学与类脑研究”,国家自然科学基金委,中国科学院,上海市,广东省及北大-清华生命科学联合中心的资助。本项目所有猕猴的脑影像数据可完全自由共享给感兴趣的同行研究者。
参考文献
1. Yan MC et al., Mapping brain-wide excitatory projectome of primate prefrontal cortex at submicron resolution and comparison with diffusion tractography, eLife, 2022, 11:e72534..
2. Cai DC et al., MECP2 duplication causes aberrant GABA pathways, circuits and behaviors in transgenic monkeys: neural mappings to patients with autism, Journal of Neuroscience, 2020, 40(19): 3799-3814.
3. Zhan YF et al., Diagnostic classification for human autism and obsessive-compulsive disorder based on machine learning from a primate genetic model, American Journal of Psychiatry, 2021, 178(1): 65-76.
4. Zhang CC et al., Anterior limb of the internal capsule tractography: relationship with capsulotomy outcomes in obsessive-compulsive disorder, Journal of Neurology, Neurosurgery, and Psychiatry, 2021, 92(6): 637-644.
5. Chen XY et al., Common and differential connectivity profiles of deep brain stimulation and capsulotomy in refractory obsessive-compulsive disorder. Molecular Psychiatry, 2022, 27(2): 1020-1030.
6. Wedeen et al., The geometric structure of the brain fiber pathways, Science, 2012, 335:1628-1633. [Catani et al., Comment on “The geometric structure of the brain fiber pathways”, Science, 2012, 337: 1605-1606]
7. Lv QM et al., Normative analysis of individual brain differences based on a population MRI-based atlas of cynomolgus macaques, Cerebral Cortex, 2021, 31(1): 341-355.
8. Curran EJ, A new association fiber tract in the cerebrum with remarks on the fiber tract dissection method of studying the brain, Journal of Comparative Neurology and Psychology, 1909, 19(6): 645-656.
本文使用产品
V03003 VSV-△G-Tau-GFP
PT-0117 AAV2/9-CaMKIIα-Tau-GFP
如需了解AAV在猕猴上表达的详细情况,请看下篇推文。
相关产品
更多产品欢迎前来咨询!
扫码下载原文
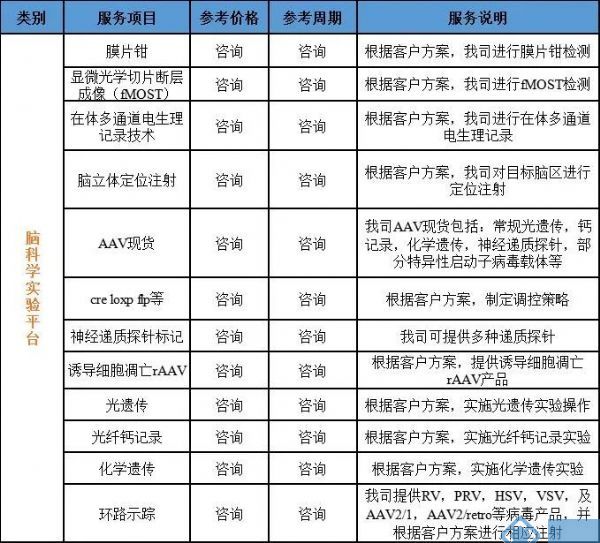
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。